摘要
01 全球药品获批情况
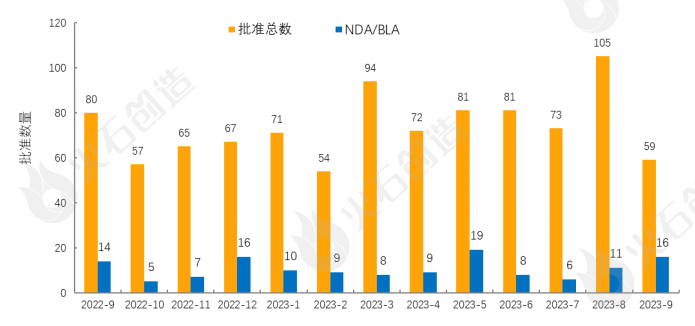
(一)美国FDA批准情况
来源:火石创造产业数据中心
其中APHEXDA是十年来首个在多发性骨髓瘤干细胞动员方面获得FDA批准的创新药物,是一款创新CXCR4抑制剂,通过皮下注射给药;GSK的OJJAARA是一款JAK抑制剂,是首个获批用于新确诊和经治、患有贫血的骨髓纤维化患者的药物,减缓该疾病的关键症状;EXXUA是FDA批准的首款用于治疗成人重度抑郁症的口服选择性5-HT1A受体激动剂,此款药物自2002年起曾被FDA拒绝上市申请多次;POMBILITI和OPFOLDA是首款针对晚发型庞贝病患者的双成分疗法,也是首款获得FDA突破性疗法认定治疗庞贝病的疗法;RIVFLOZA获批用于降低9岁及以上儿童和成人1型原发性高草酸尿症(PH1)患者的尿草酸水平,是诺和诺德所开发的首款获批RNAi疗法。

来源:火石创造产业数据中心
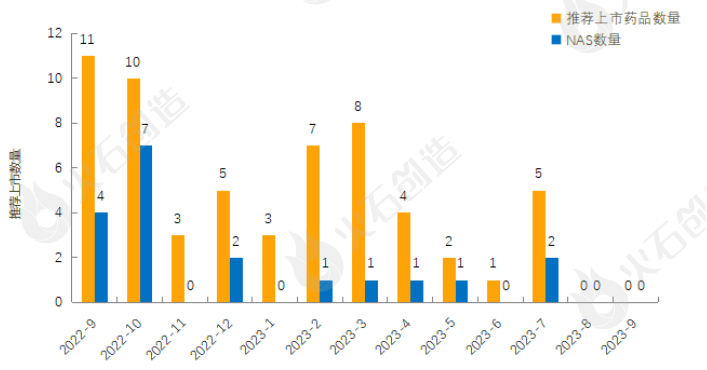
(二)欧盟EMA批准情况
来源:火石创造产业数据中心
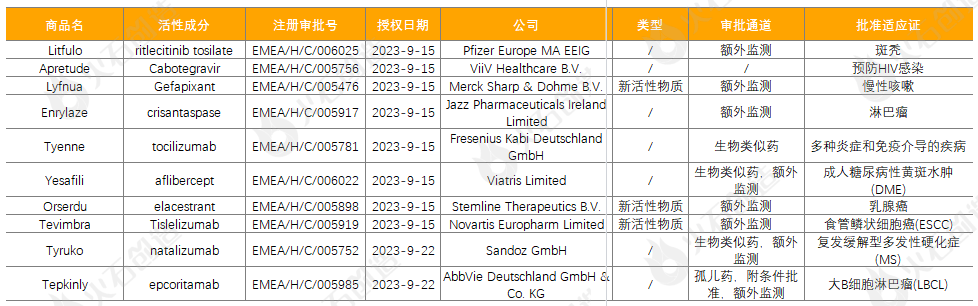
截至2023年10月10日,EMA在9月新授权10款药品上市,其中包含3款新活性物质,见表2。
来源:火石创造产业数据中心
(三)NMPA批准情况
截至2023年10月10日NMPA披露,2023年9月共批准国产首次注册药品112件。按剂型去重后,共78个药品品种(不同厂家生产同一药物按同一品种计算)。本月有1个品规(1个品种)1类创新药获批,为生物制品。2023年9月NMPA批准的1类创新药情况见表3。

来源:火石创造产业数据中心
纳鲁索拜单抗注射液是石药集团附属公司津曼特生物开发的一款IgG4亚型全人源抗RANKL单克隆抗体,此次获批上市用于治疗不可手术切除或手术切除可能导致严重功能障碍的骨巨细胞瘤成人患者,其上市为患者提供了新的治疗选择。
(三)仿制药一致性评价情况
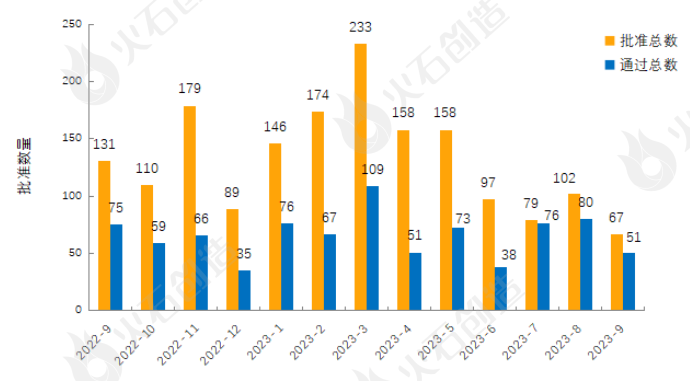
来源:火石创造产业数据中心
02 全球医疗器械获批情况
(一)美国FDA批准情况
截至2023年10月10日,9月FDA共批准309个510(k)途径的产品,其中一类器械15个,二类器械290个,未分类4个。
通过对510(k)上市前通知的器械根据美国医学专业用途进行分类,结果发现,9月产品获批类型最多的为骨科器械、放射科器械、心血管器械、一般和整形手术器械与一般医院和个人使用类器械,见图4。
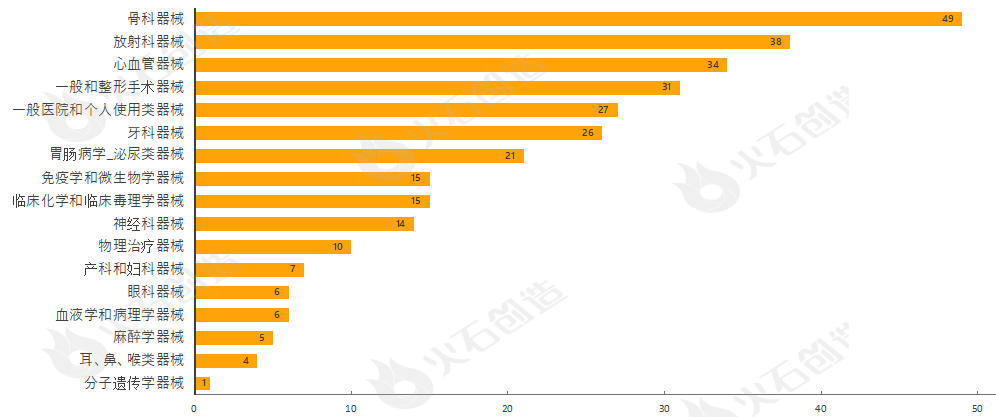
来源:火石创造产业数据中心
2023年9月有3个通过上市前批准(PMA)途径首次上市的产品。

来源:火石创造产业数据中心
(二)境内批准情况
截至2023年10月10日,2023年9月国家局公示了11个三类医疗器械进入创新审批绿色通道,见表5。
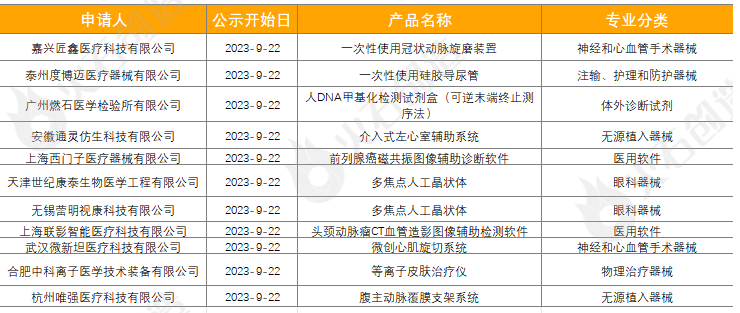
来源:火石创造产业数据中心
表6 9月获批上市的三类创新器械
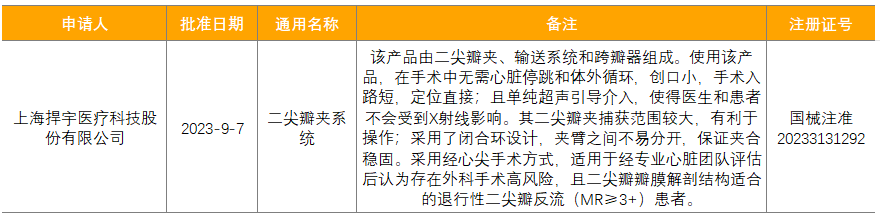
来源:火石创造产业数据中心
统计数据显示,体外诊断试剂数量最多,共1198项,占36.14%,基本上均为国产,为1181项。除体外诊断试剂,批准注册类别数量排前三位的分别为注输、护理和防护器械,口腔科器械和骨科手术器械。
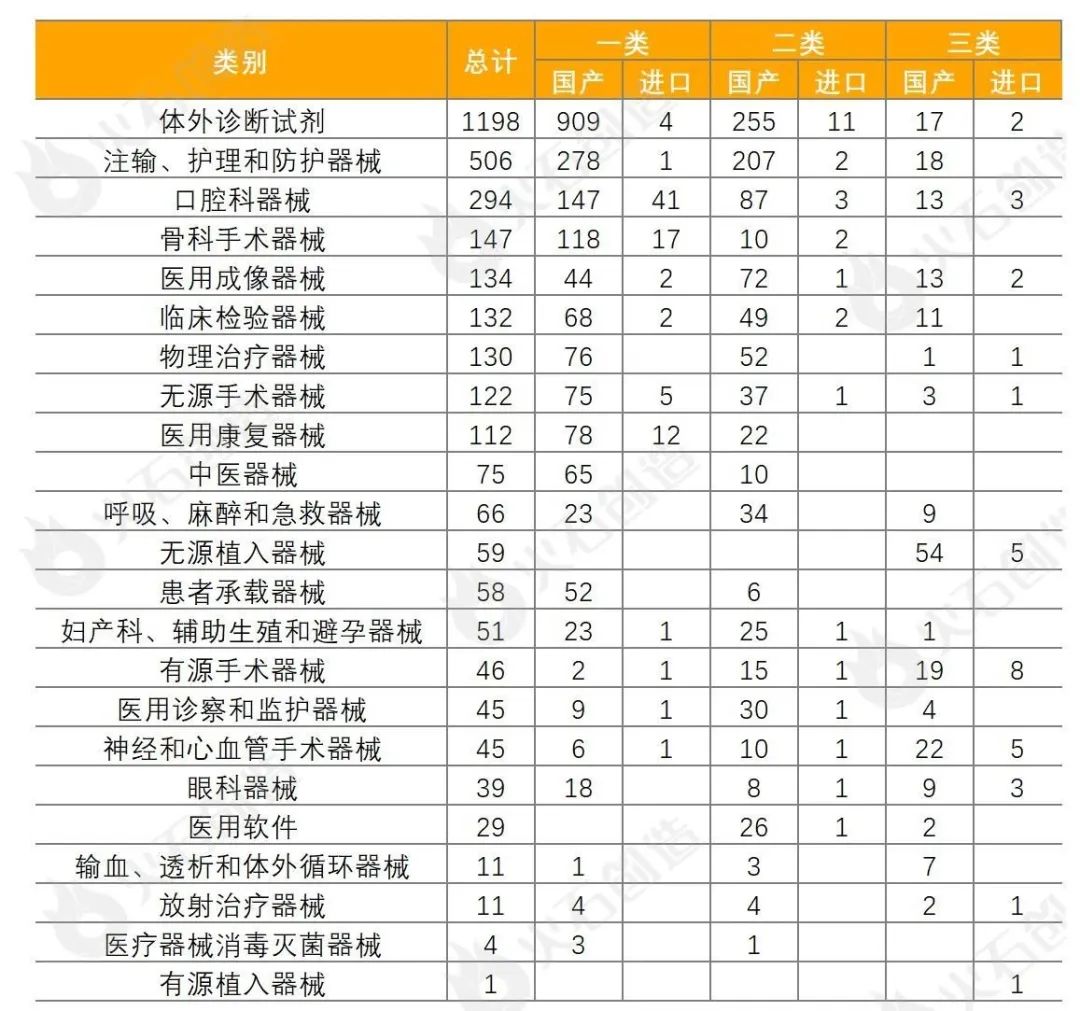
来源:火石创造产业数据中心
从地域分布上,2023年9月国产二、三类注册产品批件最多的依次为广东省(205件)、江苏省(160件)、北京市(103件)三个区域,见图5。
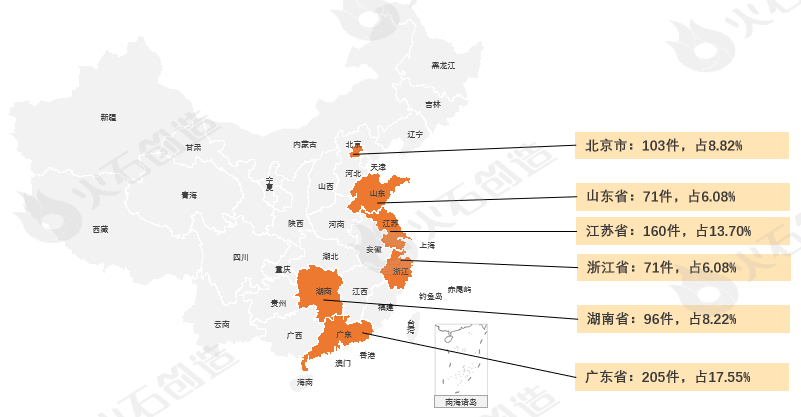
来源:火石创造产业数据中心
来源:火石创造 ,作者火石产业研究院
声明:本文观点仅代表作者本人,不代表煜森资本立场,欢迎在留言区交流补充。如需转载,请注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言。

