引言
2023年10月,全球批准较多款新药上市。FDA批准17款新药(NDA/BLA),包含3款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),7款生物制品药物(BLA);EMA未授权药品上市;NMPA批准6个品规(6个品种)创新药上市,其中2款化药,4款中药。
美国FDA批准情况
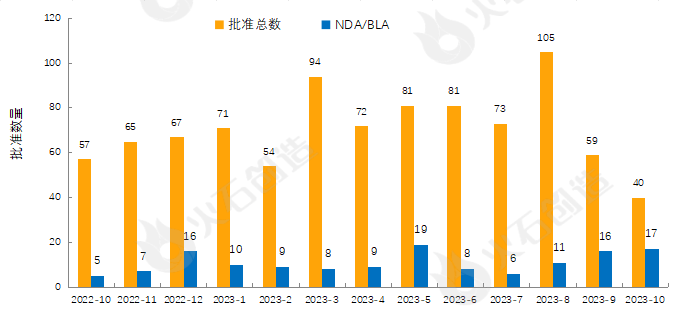
来源:火石创造产业数据中心
如图1,截至2023年11月8日FDA官网披露,2023年10月FDA共完成40项药品首次批准(不包含暂时批准),其中NDA/BLA批准17款(不包含暂时批准),见表1。其中包括3款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),7款生物制品药物(BLA)。
其中LOQTORZI(特瑞普利单抗)为君实生物研发,是我国首个在美国获批上市的自研自产创新生物药,此次获批的2项适应症覆盖了复发/转移性鼻咽癌的全线治疗,填补了美国鼻咽癌的治疗空白;
诺华的COSENTYX(司库奇尤单抗)此次获批上市为静脉注射剂,是唯一一款获批上市的IL-17A单抗静脉注射剂,也是PsA、AS和nr-axSpA等疾病在肿瘤坏死因子α(TNF-α)抑制剂以外的第二个静脉注射选择;
UCB本月获批2款NDA/BLA药品上市,其中ZILBRYSQ是首个获批用于治疗该类患者的每日一次经皮下给药的新型大环肽类C5补体抑制剂,也是唯一一款可以每日自我给药的重症肌无力靶向疗法。BIMZELX是一款人源化IgG1单克隆抗体,是FDA第一个被批准用于治疗成人中度至重度斑块状银屑病的IL-17A和IL-17F抑制剂;
XPHOZAH是ARDELYX开发的一种胃肠道中的钠离子转运蛋白NHE3抑制剂,是一种“first-in-class”药物,是首个获批的磷酸盐吸收抑制剂;
ZYMFENTRA是获FDA批准用以治疗炎症性肠病(IBD)的首个infliximab皮下制剂,可提供血清中稳定升高的infliximab单抗水平;
CABTREO(磷酸克林霉素、阿达帕林和过氧化苯甲酰)外用凝胶是首个也是当前唯一一个经FDA批准的固定剂量、三联组合的痤疮局部治疗药物;
OMVOH是首个获批用于治疗溃疡性结肠炎(UC)的IL-23抗体。

来源:火石创造产业数据中心
欧盟EMA批准情况
截至2023年11月8日EMA官网披露,2022年10月至2023年10月的推荐上市药品及新活性物质(NAS)数量情况见图2,2023年10月EMA未推荐药品上市。
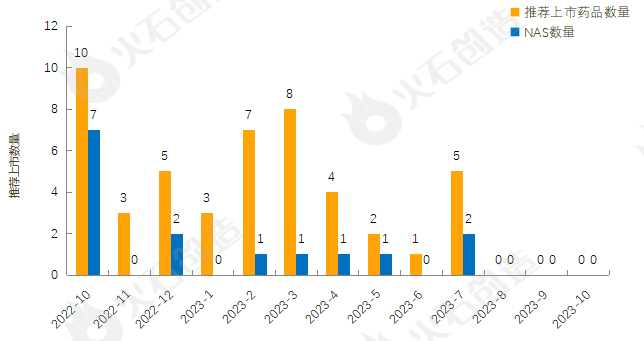
来源:火石创造产业数据中心
截至2023年11月8日,EMA在10月未授权药品上市。
NMPA批准情况
截至2023年11月8日NMPA披露,2023年10月共批准国产首次注册药品223件。
按剂型去重后,共132个药品品种(不同厂家生产同一药物按同一品种计算)。
本月有6个品规(6个品种)1类创新药获批,其中2个品规(2个品种)化药,4个品规(4个品种)中药。2023年10月NMPA批准的1类创新药情况见表2。
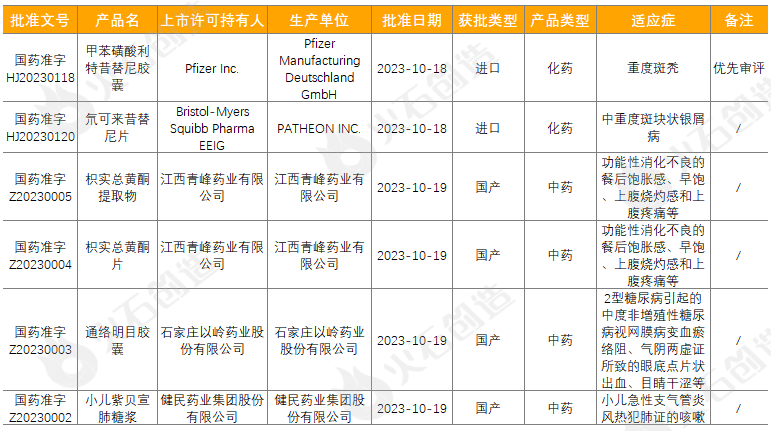
来源:火石创造产业数据中心
百时美施贵宝公司研发的氘可来昔替尼片是全球首个且目前唯一获批的酪氨酸激酶2(TYK2)变构抑制剂,本次获批上市将为中国银屑病患者带来口服靶向治疗全新方案;
辉瑞的甲苯磺酸利特昔替尼胶囊是国内获批的第二款用于系统性治疗重度斑秃的创新靶向药物(首款为礼来的巴瑞替尼片),也是唯一一个针对患有严重斑秃的青少年的治疗方法,该药品的上市为重度斑秃患者提供了新的治疗选择;
枳实总黄酮片/枳实总黄酮提取物为江西青峰药业从枳实中提取得到的总黄酮类成份,该品种上市将为功能性消化不良患者提供了又一种治疗选择;
石家庄以岭药业的通络明目胶囊化瘀通络、益气养阴、止血明目,用于2型糖尿病引起的中度非增殖性糖尿病视网膜病变血瘀络阻、气阴两虚证所致的眼底点片状出血、目睛干涩等相关症状,该药品的上市为具有上述病证的患者增加一种新的用药选择;
健民药业的小儿紫贝宣肺糖浆用于小儿急性支气管炎风热犯肺证的咳嗽,伴咳痰、汗出、咽痛、口渴,舌苔薄黄,脉浮数,该药品的上市为急性支气管炎的咳嗽患儿提供了又一种治疗选择。
仿制药一致性评价情况
截至2023年11月8日CDE官网披露,CDE共承办药品一致性评价受理号5239个,2023年10月共新增承办61个受理号。
截至2023年11月8日,共7046个品规上市药品通过一致性评价(包含视同通过3367个品规),本月共155个品规的药品通过一致性评价(包含视同通过44个品规),按剂型去重后,共84个药品品种。
目前一致性评价品种通过的注射剂共2892个品规(339个品种),本月过评药品中共计113个品规(50个品种)的注射剂。2022年10月至2023年10月通过一致性评价数量见图3。
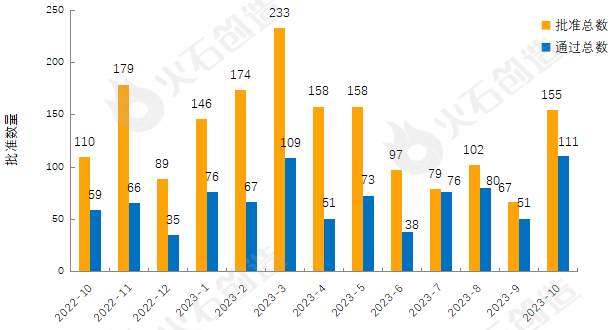
来源:火石创造产业数据中心
来源:火石创造
声明:本文观点仅代表作者本人,不代表煜森资本立场,欢迎在留言区交流补充。如需转载,请注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言。

