血液瘤药物研发或迎新变局。
4月12日,FDA召开了今年第3场肿瘤咨询委员会(ODAC)讨论会。
这次ODAC会议没有讨论具体药物的临床试验,而是聚焦于一个具有药物临床转折点意义的议题:
现有数据,是否支持微小残留病灶(MRD)作为多发性骨髓瘤(MM)临床试验的加速批准终点?
在对一系列数据进行分析讨论后,最终,专家组以12:0的投票结果,支持MRD作为替代终点,用以MM新药的加速批准。
这不仅意味着,历经多年MRD终获认证,从而有望大幅缩短MM新药的上市时间,对于抗肿瘤新型试验终点的开发和验证,或许也会产生深远的影响。
虽然上述投票结果尚不能代表FDA的最终决定,但鉴于专家组的压倒性支持,以及FDA在这次会议前的积极审查,或许MRD很快会被纳入FDA的监管实践之中。
不止是血液瘤,MRD监测在实体瘤领域也大有可为。
一项在肺癌中开展的研究证明,超过99%的MRD阴性患者没有复发,并且MRD在常规成像之前预测复发。这也意味着,肺癌MRD监测对于患者的预后管理可以起到非常关键的作用。
不仅是肺癌,包括结直肠癌、乳腺癌等实体瘤领域,MRD监测产品也都正在极速发展。未来,随着研究的推进,MRD与其他肿瘤临床终点间的关系或许也将得以揭示。
对于MM或其他肿瘤新药研发来说,未来几年,令人兴奋的挑战或许是如何更好地利用MRD来指导临床及治疗决策。
这一过程既充满希望,又伴随着诸多不确定性,但对那些能够更早为患者带来新治疗希望的药物,无疑将产生重大而有意义的影响。
/ 01 /
从ORR到MRD
在MM领域,好药辈出,大量最新的临床数据表明,无论初诊患者还是复发后的患者的中期生存相比几年前有了显著的延长。
这也对MM新药临床终点提出了新的要求。
过去,对于MM新药的上市申请,主要通过无进展生存期(PFS)和总生存期(OS)获得常规批准,或者通过客观缓解率(ORR)获得加速批准。比如,2022年强生/传奇生物的CAR-T疗法获批上市,依靠的就是98%的客观缓解率数据。
但目前,这两种类型的终点都面临着各自问题。
首先是MM治疗的缓解率普遍较高,对于新诊断的MM标准治疗已达90%以上,难以通过ORR准确反映新治疗的获益。
此前,也有研究证明,ORR数据与总生存期获益情况并不完全对等。
过去,不少肿瘤药物靠着PFS或ORR这些替代终点上市,但最终不少药物没能将这些替代终点,与OS这一金标准画上等号。所以FDA越来越希望药企能提供可靠的总生存期数据,以证明新的疗法真得可以帮助患者延长生命。
比如Abecma等CAR-T疗法,在临床中也的确出现了OS受到损害的可能。在《新英格兰医学杂志》一项III期临床研究的论文中,研究人员在附录中披露,Abecma组中有30%的患者死亡,而标准治疗组的患者死亡率为26%。
为此,FDA专门召开会议对CAR-T疗法的风险-收益进行评估。当然,最终经过FDA专家的投票,以8:3的投票认为长期获益大于风险,即Abecma的数据支持其用于三线至五线骨髓瘤治疗药时具有积极的风险获益概况。
另一方面,随着各种新型疗法的涌现,MM患者的PFS明显延长。标准治疗的中位PFS已经大于6年,中位OS大于10年。随之而来的,是新的治疗需要更长的随访时间才能显示PFS的统计学差异,加上入组时间和随访时间,甚至会超过10年。
对于药企来说,很难接受一项临床动辄8年甚至10年,毕竟新药的专利期是有限的;患者也很难用上新的治疗药物。
这种情况下,需要改革开发新的终点,用以早期能够准确预测患者长期临床结果,使得新的有效治疗能及时上市,给仍无法获得治愈的MM患者带来获益。
MRD站了出来。
所谓MRD,即微小残留病灶,指癌症患者接受治疗后残留的肿瘤细胞,含量或许微乎其微,但仍可能会引起患者癌症复发。
尽管MM仍不可治愈,但治疗选择非常多。从以前的化疗、移植,到蛋白酶体抑制剂、免疫调节剂、抗血管生成抑制剂,MM预后得到了显著改善,如今随着CD38单抗、ADC以及CAR-T疗法这些好药的出现,MM更是趋于“慢性病”。
因此,对患者预后的监测和复发的早筛也随之变得越来越重要。全球范围内,血液瘤患者治疗后需要监控MRD,早已是共识。
过去几年,医学界也一直在研究,如何将高质量的MRD数据和报告作为完善MRD预后作用的基础,并成为支持评估临床上有意义的终点。
如今,在肿瘤学专家审查了支持多发性骨髓瘤药物批准的替代终点的数据后,FDA咨询委员会的12名成员一致投票,支持使用MRD作为替代终点,以加速批准多发性骨髓瘤的新疗法。
有市场人士表示,鉴于专家组的压倒性支持,以及FDA在这次会议前的积极审查,或许MRD很快会被纳入FDA的监管实践之中。
/ 02 /
时机愈发成熟
通过MRD,研究人员使用最灵敏的技术,如流式细胞术NGF或二代测序NGS,来测量疾病负担。
NGF和NGS分别可以将MRD检测敏感度提高到10-5以上。MRD阴性也即105个有核细胞中可检测出少于1个克隆性浆细胞。即MRD阴性结果,它代表了比ORR和CR更深层次的肿瘤清除。
有报道称,MRD阴性更能准确提示患者预后。因此,国际骨髓瘤工作组IMWG也在传统疗效评估以外,新增了MRD疗效评估。更有学者提出,MRD阴性应成为新的CR标准。
2020 年,发表在《血液进展》杂志上的一项大型荟萃分析(涉及 44 项多发性骨髓瘤临床研究以及来自近 8100 名患者的 PFS 数据)表明,实现 MRD 阴性可以将疾病进展或死亡的风险降低 67%。根据该论文,在23项研究中,有近4,300名患者的总生存数据,MRD阴性与死亡风险改善55%有关。
这项研究在学术界引起了轰动,但FDA没有被说服。4月12日,FDA专家召开咨询委员会会议审查新数据,专家在审查EVIDENCE和i2TEAMM对过去临床试验进行的两项独立荟萃分析数据后,全票支持MRD作为替代终点。
具体来看,EVIDENCE的研究,选取了在新诊断MM患者中开展的16项2/3期随机对照研究,筛选汇总进行Meta分析,其中选取研究的MRD敏感性都达到10-5以上,研究主要目的是评估MRD阴性能否作为长期临床获益的合理替代终点。
结果显示,个体患者水平MRD与长期获益存在强相关性,在所有新诊断MM(NDMM),以及符合与不符合移植条件的新诊断患者(NDTE和NDTinE),与PFS的Global OR(全局比值比,大于1的Global OR 越高,代表相关性越强)水平分别为4.72、2.45和6.15, 显示出患者MRD与PFS强相关性。类似地,结果同样显示患者MRD与OS结果的强相关性。
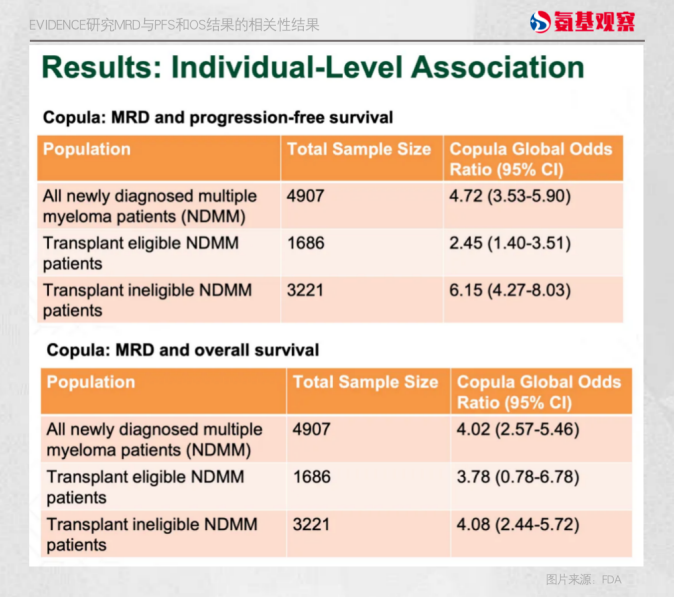
而在反映MRD终点与研究长期终点相关性的试验水平方面,结果显示,在所有NDMM中,MRD与PFS/OS存在一定程度的相关性。比如,在OS方面,在所有NDMM中,由于进展后交叉或接受其他线数的治疗,MRD与OS终点呈现出弱至中等相关;而在NDTinE中,MRD与OS终点呈现出中等至强相关。
i2TEAMM研究则纳入了20项多中心随机对照研究,对超过1.2万名新诊断及复发难治MM患者(NDTE,NDTinE和RR)的数据进行Meta分析,以评估早期MRD终点(9个月及12个月MRD阴性率)是否能作为预测长期临床获益的早期终点。
结果显示,9个月MRD阴性与PFS终点,在NDTE、NDTinE与RR患者中的Global OR值分别达到3.06、9.80和8.24,显示出强相关性;在OS终点中,也显示出强相关性。
而在试验水平方面,结果显示,9个月MRD阴性率显示出与PFS、OS终点均呈中等强度相关。
综合分析,EVIDENCE及i2TEAMM均认为MRD可以作为支持MM加速获批的合理终点。
越来越多数据分析证明,使用MRD作为替代终点的时机或许已经成熟。
总体上,FDA认可上述两个独立Meta分析的方法和结果。与此同时,基于两个申请人提交的所有数据,FDA还开展了额外的Meta分析,以验证利用所有数据是否会影响结果或结论。
结果显示,个体患者水平,在所有不同MM人群中,9个月与12个月MRD阴性与PFS和OS分别显示出强相关性;试验水平方面,MRD与PFS在多数疾病亚组中显示出弱至中等的相关性,NDTinE亚组中显示出强相关性;MRD与OS的相关性总体更弱。
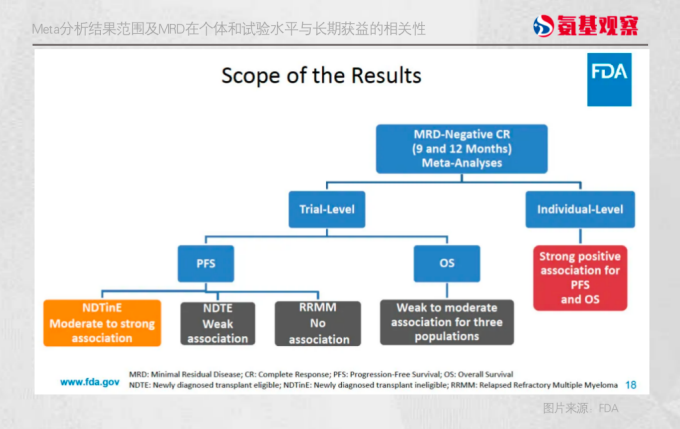
虽然MRD的改善可能无法预测长期临床益处的风险,但FDA也指出这是使用任何早期终点的风险。
/ 03 /
新的转折点?
如果FDA最终同意以MRD作为替代终点,这将意味着骨髓瘤新药开发的一个转折点,药企的临床时间将大大缩短,药物能够更快地到达患者手中。
在此前的美国血液学会年会上,来自Atrium Health的医学博士 Peter Voorhees 提出了一项假设的3期试验,该试验将针对强生的Darzalex或赛诺菲的Sarclisa与武田的Velcade、百时美施贵宝的Revlimid和类固醇地塞米松的组合的双抗用于符合干细胞移植条件的一线患者。
根据Voorhees的计算,为了在统计学上显示PFS益处,该试验需要招募1700多名患者,并且需要近10年的时间才能达到最终的PFS分析。
但如果基于MRD作为替代终点,情况就会不一样了。弗雷德·哈奇癌症中心研究多发性骨髓瘤的医生研究员拉胡尔·班纳吉估计,在某些情况下,基于MRD的治疗效果分离可能在治疗后四个月就开始显现。
负责EVIDENCE研究的Landgren博士相信,在试验开始3年后,就可以读出有意义的、具有统计学意义的MRD改善。
而在i2TEAMM的研究中,若以MRD作为早期终点,研究结果可在9至12个月内获得,而不是5年多的时间。
那么,如何应用MRD加速MM新药研发呢?
根据FDA的补充说明,在传统的“后线单臂-前线随机对照”的两个试验开发方法中,MRD可以在复发难治MM的后线治疗的单臂研究中替代ORR,基于MRD和DOR的缓解时间以获得加速批准,并继续在前线治疗的随机对照研究中,将MRD作为次要终点进一步验证。
另一种方式则是FDA推荐的 “单一试验方法”,可以基于一个随机对照试验中的MRD评估,如MRD未达阳性仍可继续研究,再通过同一试验中对长期临床结果进行随访,基于PFS和OS等长期获益获得常规批准。
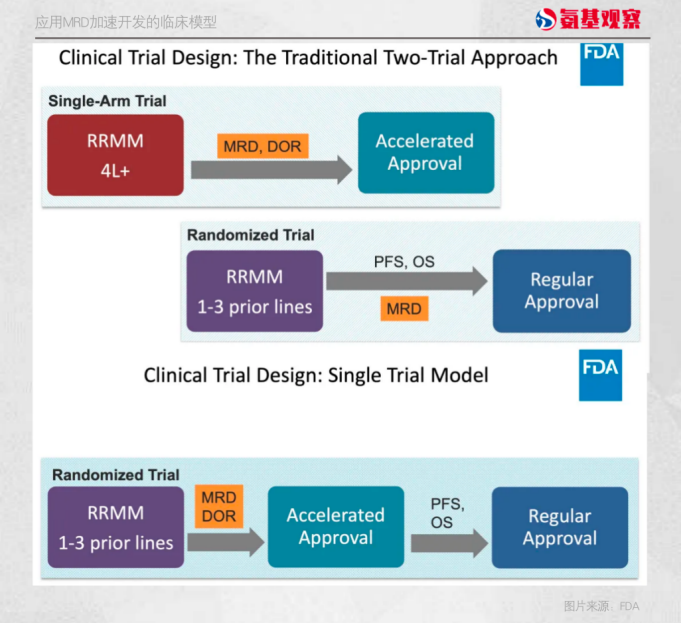
当然,这仍存在一些局限性和不确定性。比如,可能由于时间原因,CAR-T疗法的试验未被纳入meta分析。此外,各试验的评估时间和随访时间各不相同。
此外,由于试验需要满足一些预先设定的标准才能纳入meta分析,因此结果可能无法反映其他未达到标准的试验中MRD与PFS之间的关系。
而在去年《临床癌症研究》发表的一篇文章中,包括肿瘤学主任Richard Pazdur在内的FDA官员指出了,过去使用MRD的血液瘤药物应用存在的几个问题。如在评估的癌症类型中,多发性骨髓瘤“尽管提交数量最多,但MRD数据的接受率最低”。
FDA指出,主要问题源于检测MRD的检测方法。在许多情况下,基于NGS的检测无法鉴定出适合追踪的恶性肿瘤。FDA表示,这些缺失的数据使整体结果无法解释。
FDA专家小组提出的另一个担忧是,开放MRD方法可能对药物开发产生潜在的意外后果。由于过于关注MRD,药企可能会放弃不显示早期MRD信号的有效药物。这也是为什么FDA更推荐采用“单一试验”方法。
虽然关于如何最好地使用MRD仍然存在悬而未决的问题,但FDA也表示,进行的荟萃分析代表了对MRD的稳健评估,支持其预后价值,提供有关MRD评估适当时机的信息,并表明MRD可能适合用作支持加速批准的中间临床终点。
不过,MRD与其他支持加速批准的临床终点一样,一切的前提是最终能够证明长期获益。而随着监管的转变,MRD或许也将再次迎来一个加速发展的转折点。
全球范围内,血液瘤患者治疗后需要监控MRD,早已是共识;而实体瘤MRD检测的临床研究,同样热火朝天。包括肺癌、结直肠癌、乳腺癌等实体瘤领域,MRD监测产品也都正在极速发展。
可以确定的是,未来MRD检测并不会局限在血液瘤领域,更会在实体瘤领域大展拳脚。当然,从敏感性、克隆异质性、可及性和样本要求等方面来看,实体瘤MRD对于技术的要求更高。
任何时候,可靠的检测技术获得的MRD都是预后管理的重要指标,在此基础上,才能更进一步研究、揭示其与肿瘤临床终点、患者长期获益间的关系。
这一次,FDA专家的全票支持,意味着多年MRD终获认证,这或许是肿瘤药物临床终点变化的一个开端。
对于MM或其他肿瘤新药研发来说,未来几年,令人兴奋的挑战或许是如何更好地利用MRD来指导临床及治疗决策。
声明:本文观点仅代表作者本人,不代表煜森资本立场,欢迎在留言区交流补充。如需转载,请注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言。

