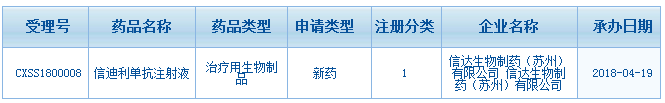
4月19日,信达生物重新提交的PD-1单抗信迪利单抗注射液的上市申请(CXSS1800008)正式获得药品审评中心承办受理。
另外,医药魔方通过信达生物负责人了解到,信达生物使用信迪利单抗的国内临床数据向FDA提交了美国新药临床研究申请(IND),已经获得FDA的临床许可,并且准许跃过I期临床直接进入美国II/III期临床研究。这标志着信迪利单抗在质量和安全性方面获得了美国FDA的初步认可。
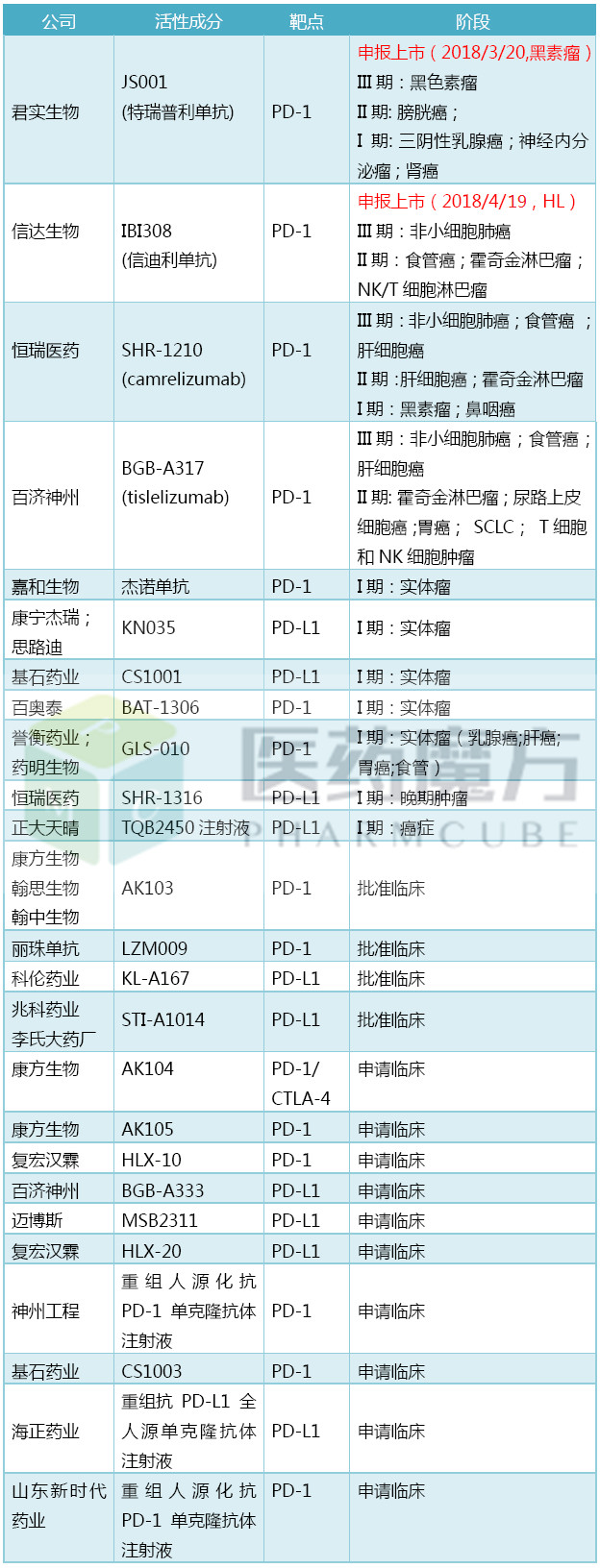
PD-1/PD-L1是肿瘤免疫治疗领域最热门的靶点,行业关注度极高,国内在研厂家众多,竞争空前激烈。截止目前,已经有25个国产PD-1/PD-L1向CFDA提交了注册申请。
国内注册申报的PD-1/PD-L1药物
在过去的几个月中,信达生物作为首家递交国产PD-1单抗上市申请的企业成为业内关注的焦点。但由于此前尚无同类国产药物申报上市的先例,CDE在审批过程中极其严格谨慎,为此还在2018年1月12日专门组织召开了“抗PD-1/PD-L1单抗申报资料要求专题研讨会”,参会人员包括正在开展PD-1/PD-L1药物临床试验的部分企业代表、临床KOL以及CDE的肿瘤药审评专家等。
经过广泛深入的研讨后,CDE于2018年2月8日发布了《抗PD-1/PD-L1单抗品种申报上市的资料数据基本要求》,标志着国内药品审批部门、审评专家、药企对于PD-1等单抗药物的上市申报要求达成共识,形成了中国行业统一标准(见:CDE发布PD-1单抗申报新规,国产厂家竞跑重新启动)。
PD-1/PD-L1申报新规发布后,信达生物于2018/2/11主动撤回了2017/12/13被CDE承办受理的上市申请,并根据CDE新的申报指南再次递交了上市申请。信达生物董事长俞德超博士此前曾对医药魔方表示:“CDE组织各方代表研究发布PD-1/PD-L1申报新规,一方面说明中国对PD-1这样一种前沿药物的监管还在探索中前进;另一方面也可以看到中国药监机构对此持高度严谨的态度。信达生物会一如既往地支持国家药审中心一切有利于药物创新的改革。”
信达生物PD-1单抗的申报可谓一波三折,但却一定程度上加快了中国PD-1单抗申报标准的制定和出台,为行业统一标准打了前站。在《抗PD-1/PD-L1单抗品种申报上市的资料数据基本要求》发布后,国内PD-1/PD-L1的研发有了明晰的规范标准体系,后续研发注册将更趋理性。
目前已有包括百济神州、信达生物、恒瑞医药、君实生物、丽珠单抗、康宁杰瑞/思路迪、复宏汉霖、迈博斯等多家企业的PD-1/PD-L1药物同步开展了美国IND申报并获得许可,这也说明中国药企已做好了接受中国和国际标准双重检验的准备。

